SIND SIE ANGEHÖRIGER DER MEDIZINISCHEN FACHKREISE?
JA, ICH BIN ANGEHÖRIGER MEDIZINISCHER FACHKREISE*
Über HEMGENIX®
HEMGENIX® ist eine wegweisende Gentherapie, die einer Vielzahl von Hämophilie-B-Patienten die Chance auf eine langjährige Freiheit von der Faktorprophylaxe bietet. HEMGENIX® kann mit einer einzigen Infusion langfristig gesteigerte FIX-Spiegel, Prophylaxefreiheit und eine Reduktion der Blutungsrate erreichen.1,2,3,9,11

HEMGENIX® IST DIE ERSTE IN EUROPA FÜR DIE BEHANDLUNG DER HÄMOPHILIE B§ ZUGELASSENE GENTHERAPIE. SIE SETZT AN DEREN URSACHE AN UND KANN DIE LEBENSQUALITÄT DER PATIENTEN ERHÖHEN.1,2,3,11
HEMGENIX® bringt eine funktionsfähige Kopie des F9-Gens in die Leber ein, um die F9-Mutation zu kompensieren und so die Ursache der Hämophilie B zu beheben. Diese innovative Gentherapie besteht aus einem nicht replizierenden, rekombinanten Adeno-assoziierten Virus vom Serotyp 5 (AAV5) als Vektor, der - unter der Kontrolle eines leberspezifischen Promotors - die hochaktive Padua-Proteinvariante des Faktor-IX kodiert. Diese natürlich vorkommende Padua-Variante des FIX-Proteins hat eine 6- bis 8-fach höhere spezifische Aktivität als das häufigere Wildtyp-FIX-Enzym. Bei gleicher Dosis und Transduktionseffizienz lassen sich so höhere endogene FIX-Aktivitäten erzielen.2,3,4,5,6
SIGNIFIKANTE WIRKSAMKEITSDATEN DER PHASE III STUDIE (HOPE B) ZU MONAT 361,2,3,11,12,*,(*)
94%
der Patienten beendeten die Routine-FIX-Prophylaxe und blieben prophylaxefrei1,2,3,11*
64%
Verringerung der jährlichen Blutungsrate (ABR) im Vergleich zu einer ordnungsgemäß durchgeführten Prophylaxe in der Lead-In-Phase1,2,3,11**
38,6%
stabile mittlere FIX-Aktivität auch 3 Jahre nach der Therapie1,2,11,†
keine behandlungsbedingten schwerwiegende unerwünschte Ereignisse1,2,3,‡
Der Wirkmechanismus der GENTHERAPIE für Hämophilie erklärt
Sowohl Hämophilie A wie auch Hämophilie B sind monogen, X-chromosomal, rezessiv-vererbte Krankheiten, die sich für eine Gentherapie eignen.2,7 Die Gentherapie der Hämophilie A bzw. B zielt darauf ab, die endogene Produktion und damit Konzentration des Gerinnungsfaktors-VIII bzw. -IX durch die Bereitstellung eines neuen funktionellen Gens bzw. einer kodierenden Sequenz zu erhöhen um dadurch die klinischen Ergebnisse zu verbessern und den Bedarf einer Faktorprophylaxe zu verringern bzw. ganz zu beseitigen.2,8,9
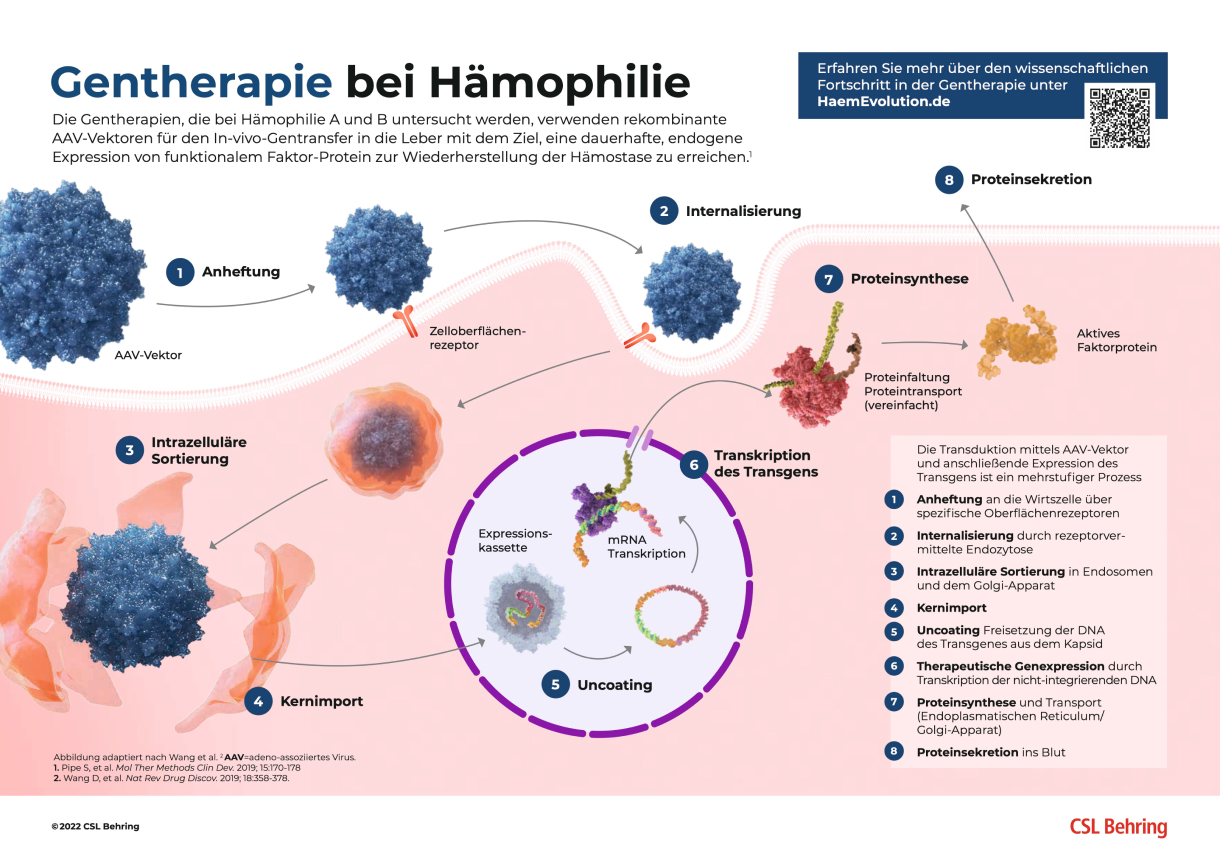
Gentherapie Wirkmechanismus Infografik
In dieser Infografik des Wirkmechanismus wird die Gentherapie bei Hämophilie in 7 Schritte unterteilt, von der Bindung des AAV-Vektors bis zur Synthese des Gerinnungsfaktorproteins.
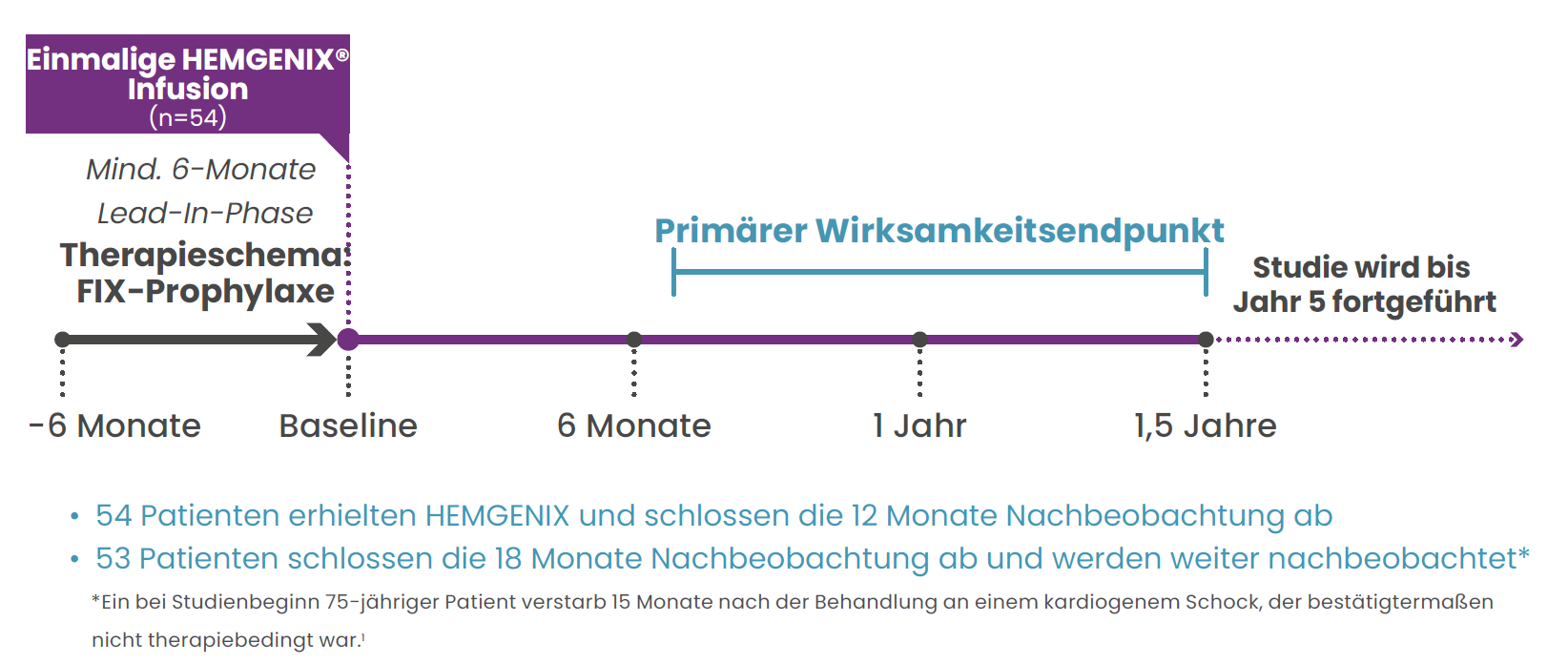
HOPE-B: Eine wegweisende Phase-3-Studie
Das solide Wirksamkeits-, Sicherheits- und Verträglichkeitsprofil von HEMGENIX® wurde in der multinationalen, zulassungsrelevanten Phase-3-Studie HOPE-B belegt.2,3,10,11
An HOPE-B nahmen 54 männliche Patienten im Alter von ≥18 Jahren mit angeborener Hämophilie B (FIX-Aktivität ≤2% des Normalwertes) teil, die bis zum Screening bereits seit mindestens 2 Monaten eine FIX-Prophylaxe erhielten.1,2
Primärer Endpunkt:1,2,3,11
Vergleich der annualisierten Blutungsrate (ABR) für alle Blutungen unter HEMGENIX® und unter Prophylaxe im Hinblick auf Nichtunterlegenheit zwischen der 6-monatigen Lead-In-Phase und den ersten 52 Wochen ab stabiler FIX-Expression (Monat 7–18).
Wichtige sekundäre Endpunkte:2,3,11
- FIX-Aktivität 6, 12 und 18 Monate nach der Behandlung
- Anteil Patienten, die weiterhin frei von FIX-Prophylaxe waren
- Auftreten und Auflösung von Zielgelenken und Anteil der Patienten ohne Blutungen
- Korrelation der FIX-Aktivitätswerte mit dem Titer vorbestehenden neutralisierender Anti-AAV5-Antikörper (AAV5-NAb)
- Unerwünschte Ereignisse
Der primäre Endpunkt wurde erreicht, wobei die Patientendaten für die ersten 18 Monate nach der Behandlung mit HEMGENIX® ausgewertet wurden. Die Nachbeobachtung der Patienten wird für 5 Jahre fortgesetzt.2,3,11
Zurück
Startseite
Weiter
Klinische Daten
Referenzen
- EU Fachinformation HEMGENIX® (Europäische Arzneimittelagentur, 02/2024)
- Coppens M et al. Adults with haemophilia B receiving Etranacogene Dezaparvovec in the HOPE-B Phase 3 Trial experience a stable increase in mean Factor IX activity and durable haemostatic protection after 24 months’ follow-up. Vorgestellt: 16. Kongress der European Association for Haemophilia and Allied Disorders; Februar 2023; Manchester; Vereinigtes Königreich.
- Pipe SW et al. Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B. N Engl J Med 2023; 388:706-718. (+ Suppl. Appendix)
- Nathwani AC. Gene therapy for Haemophilia. Hematology Am Soc Hematol Educ Program. 2019;2019(1):1-8.
- Thornburg CD. Etranacogene dezaparvovec for hemophilia B gene therapy. Ther Adv Rare Dis. 2021;2: 1–14.
- Von Drygalski A, et al. Etranacogene dezaparvovec (AMT-061 phase 2b): normal/near normal FIX activity and bleed cessation in hemophilia B Blood Advances. 2019; 3(21): 3241-47.
- Rodríguez-Merchán EC, et al. Gene Therapy in Hemophilia: Recent Advances. Int. J. Mol. Sci. 2021;22:7647-67.
- Miesbach W, et al. Gene therapy with adeno-associated virus vector 5–human factor IX in adults with hemophilia B. Blood. 2018;131(9):1022-31.
- Perrin GQ, Herzog RW, Markusic DM. Update on clinical gene therapy for Haemophilia. Blood. 2019;133(5):407-414.
- Pipe SW, et al. First Data from the Phase 3 HOPE-B Gene Therapy Trial: Efficacy and Safety of Etranacogene Dezaparvovec (AAV5-Padua hFIX variant; AMT-061) in Adults with Severe or Moderate-Severe Hemophilia B Treated Irrespective of Pre-Existing Anti-Capsid Neutralizing Antibodies. Blood. 2020;136(Suppl 2): LBA-6.
- Pipe SW et al, Poster P0156 - Adults with haemophilia B receiving etranacogene dezaparvovec in the HOPE-B Phase 3 clinical trial experience a stable increase in mean factor IX activity and durable haemostatic protection after 24 months’ follow-up; 16. EAHAD-Kongress 8.-10. Februar 2023, Manchester, Vereinigtes Königreich.
- Pipe SW et al, 1055 LongTerm Bleeding Protection, Sustained FIX Activity, Reduction of FIX Consumption and Safety of Hemophilia B Gene Therapy:Results from the HOPE-B Trial 3 Years after Administration of a Single Dose of Etranacogene Dezaparvovec in Adult Patients with Severe or Moderately Severe Hemophilia B; Oral presentation 11.12.2023; 65.ASH-Kongress, San Diego, USA. https://ash.confex.com/ash/2023/webprogram/Paper187624.html.
§ Hemgenix ist indiziert zur Behandlung von schwerer und mittelschwerer Hämophilie B (angeborener Faktor-IX-Mangel) bei erwachsenen Patienten ohne Faktor-IX-Inhibitoren in ihrer Vorgeschichte.
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung.
HEMGENIX® 1 x 1013 Genomkopien/ml Konzentrat zur Herstellung einer Infusionslösung. Wirkst: Etranacogen dezaparvovec Zusammensetz: Ein Milliliter an Etranacogen dezaparvovec enthält 1 x 1013 Genomkopien (gk). Eine Durchstechflasche enthält ein extrahierbares Volumen von 10 ml Konzentrat zur Herstellung einer Infusionslösung mit insgesamt 1 x 10 14 Genomkopien. Die Gesamtzahl der Durchstechflaschen in jeder Packung entspricht dem Dosierungsbedarf für den betreffenden Patienten, abhängig vom Körpergewicht des Patienten. Sonst. Bestandteile: Dieses Arzneimittel enthält 35,2 mg Natrium pro Durchstechflasche (3,52 mg/ml), Saccharose, Polysorbat-20, Kaliumchlorid, Kaliumphosphat, Natriumchlorid, Natriumphosphat, Salzsäure (zur pH-Einstellung), Wasser für Injektionszwecke. Anw: Hemgenix ist indiziert zur Behandlung von schwerer und mittelschwerer Hämophilie B (angeborener Faktor-IX-Mangel) bei erwachsenen Patienten ohne Faktor-IX-Inhibitoren in ihrer Vorgeschichte. Gegenanz.: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile; Aktive Infektionen, sowohl akute wie unkontrollierte chronische; Patienten mit bekannter fortgeschrittener Leberfibrose oder -zirrhose. Nebenwirk: Aus klin. Studien Sehr häufig: Kopfschmerzen, Alanin-Aminotransferase erhöht, Aspartat-Aminotransferase erhöht, C-reaktives Protein erhöht, Grippeähnliche Erkrankung, Infusionsbedingte Reaktion (Überempfindlichkeit, Reaktion an der Infusionsstelle, Schwindelgefühl, Juckreiz am Auge, Hitzewallungen, Oberbauchschmerzen, Urtikaria, Beschwerden im Brustkorb, Pyrexie). Die Häufigkeit ergibt sich aus gepoolten infusionsbedingten Reaktionen mit ähnlichem Krankheitsbild. Einzelne Infusionsreaktionen traten bei 1 bis 2 Patienten mit ähnlicher Häufigkeit auf (Inzidenz 1,8 bis 3,5 %); häufig: Schwindelgefühl, Übelkeit, Müdigkeit, Unwohlsein, Kreatinphosphokinase im Blut erhöht, Bilirubin im Blut erhöht.
Weitere Hinweise siehe Fachinformation. Verschreibungspflichtig. Zulassungsinhaber: CSL Behring GmbH, Emil-von-Behring-Straße 76, D-35041 Marburg Stand: Februar 2024.
Haben Sie eine medizinische Frage? Wenden Sie sich bitte an unsere Abteilung "Medizinische Information"
Vielen Dank für Ihre Anfrage, die wir in Kürze beantworten werden!